Una publicación de la FDA de los informes internos de farmacovigilancia de Pfizer sobre las reacciones adversas de su nueva vacuna de terapia génica para la enfermedad de Coronavirus 2019 (COVID-19) revela que las mujeres sufrieron más efectos secundarios que los hombres en una proporción de más de 3:1, y que la mayor parte de las reacciones afectaron a personas de ambos sexos de entre 31 y 50 años.
Los datos han sido publicados por la organización Public Health and Medical Professionals for Transparency (PHMPT), una organización sin ánimo de lucro compuesta por 80 personas, en su mayoría profesionales de la medicina.
ARTÍCULOS RELACIONADOS:
Success
You are now signed up for our newsletter
Success
Check your email to complete sign up
55 largos años para revisar documentos de la vacuna COVID19 de Pfizer
El PHMPT dice en su sitio web que presentó una solicitud de FOIA a la FDA el 23 de agosto después de que se concediera a Pfizer la aprobación para distribuir su inyección a jóvenes mayores de 16 años para «todos los datos dentro del archivo del producto biológico de la vacuna COVID-19 de Pfizer».
Durante la presentación, la organización solicitó específicamente la tramitación acelerada, la cual es permitida en Estados Unidos, según se señala en su carta de solicitud.
La FDA denegó al PHMPT la tramitación acelerada, alegando que la solicitud «no demostraba una necesidad imperiosa que implicara una amenaza inminente para la vida o la seguridad física de una persona» o «que existiera una urgencia de informar al público sobre una actividad real o supuesta del gobierno federal», según los expedientes.
En consecuencia, el PHMPT presentó una demanda el 16 de septiembre ante el Tribunal de Distrito de Texas, con el fin de obligar a la Agencia a cumplir la solicitud.
A mediados de noviembre, el Departamento de Justicia, que representa a la FDA, dijo a los tribunales que necesitaría 55 años para revisar y redactar la información de las 329.000 páginas de documentos que tiene a su disposición, a un ritmo de 500 páginas al mes.
Los abogados del Departamento de Justicia dijeron a los tribunales que la entidad gubernamental que procesa las solicitudes de la FOIA sólo cuenta con diez miembros del personal y está pendiente de 400 solicitudes, según Reuters.
El artículo dice que el juez Mark Pittman, que preside el caso, fijó una fecha de conferencia para el 14 de diciembre «para considerar el calendario de procesamiento de los documentos».
Mejor que el VAERS
Sin embargo, el PHMPT tiene una copia de un documento preparado por la división de Seguridad Mundial de Pfizer titulado Análisis Acumulativo de Informes de Eventos Adversos Post-Autorización. El documento contiene los datos de reacciones adversas recogidos por la Big Pharma hasta el 28 de febrero de 2021, apenas unos meses después de que su inyección fuera la primera en recibir una autorización de uso de emergencia en diciembre de 2020.
El documento está fechado por el PHMPT como el 17 de noviembre y es descrito en su interior por Pfizer como «un análisis integrado de los datos de seguridad acumulativos posteriores a la autorización, incluyendo los informes de eventos adversos posteriores a la autorización en Estados Unidos y en el extranjero».
Sólo hay unas pocas redacciones del DOJ. En concreto, el número de personal a tiempo completo que Pfizer dice haber contratado y que tenía previsto contratar «para ayudar a paliar el gran aumento de informes de eventos adversos», y el número de inyecciones que había enviado a todo el mundo en ese momento.
La base de datos interna de reacciones adversas a las vacunas de Pfizer, en la que se basa el informe, contiene información recopilada de:
- Informes espontáneos a Pfizer
- Informes de las autoridades sanitarias
- Casos publicados en la literatura médica
- Los procedentes de «programas de comercialización patrocinados por Pfizer» y «estudios no intervencionistas»
- Casos «de EA [reacciones adversas] graves»
- Informes de estudios clínicos «independientemente de la evaluación de la causalidad»
Pfizer añade una cláusula de exención de responsabilidad a su conjunto de datos, en la que se afirma que «los informes se presentan de forma voluntaria, y se desconoce la magnitud de la información reportada», y que «en algunos informes, la información clínica (como la historia clínica, la validación del diagnóstico, el tiempo transcurrido desde el uso del medicamento hasta el inicio de la enfermedad, la dosis y el uso de medicamentos concomitantes) falta o es incompleta, y la información de seguimiento puede no estar disponible”.
No obstante, la empresa señala que «sólo se incluyen en el informe aquellos [EA] que tienen un ciclo de trabajo completo en la base de datos de seguridad».
De todos modos, la empresa también revela que, a pesar del «gran número de informes de eventos adversos espontáneos recibidos para el producto», Pfizer «dio prioridad al procesamiento de los casos graves».
Datos duros
Frente a un número redactado de dosis enviadas en todo el mundo hasta el 28 de febrero de 2021, Pfizer reveló que su conjunto de datos, compuesto por el criterio anterior, contenía 42.086 casos, de los cuales 25.379 estaban confirmados médicamente.
Más de 27.000 del total de casos se notificaron en Estados Unidos y el Reino Unido.
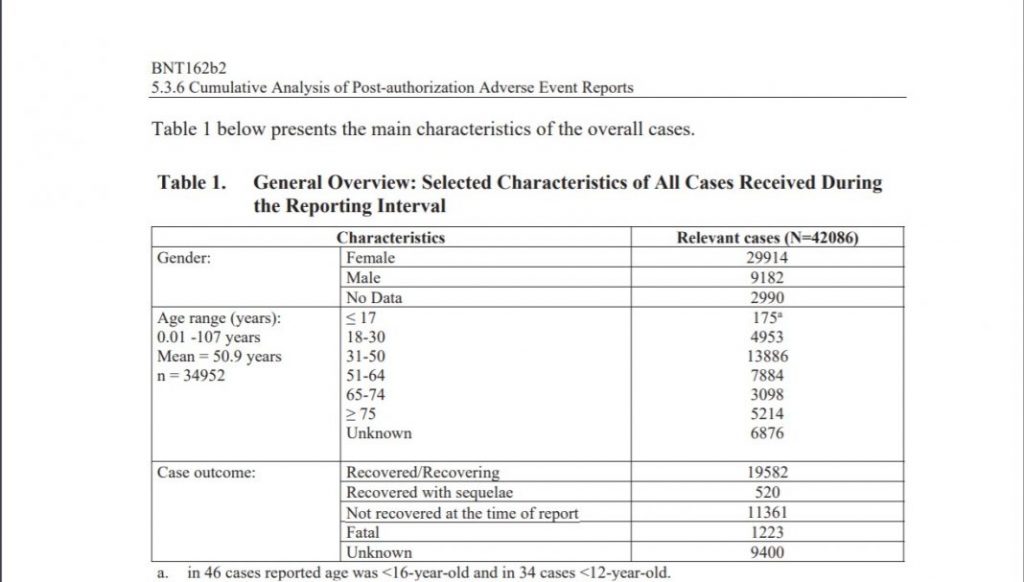
Los datos del Análisis Acumulativo de Informes de Eventos Adversos Post-autorización de Pfizer hasta el 28 de febrero de 2021, publicados por la FDA en respuesta a una solicitud de la FOIA, muestran que la mayoría de las reacciones adversas en la propia base de datos de Pfizer se produjeron en mujeres, siendo el grupo más numeroso el de personas de entre 31 y 50 años. (Imagen: Captura de pantalla de la seguridad mundial de Pfizer publicada por la FDA, titulada Análisis acumulativo de informes de eventos adversos posteriores a la autorización hasta el 28 de febrero de 2021)
En un resumen demográfico, Pfizer reveló una cifra sorprendente: 29.914 de los casos fueron notificados en mujeres, mientras que sólo 9.182 fueron notificados en hombres. Otros 2.990 eran de sexo desconocido.
Además, desglosado por edad, mientras que las personas de 18 a 30 años representaron 4.953 casos y las de 51 a 64 años 7.884, las de 31 a 50 años fueron con diferencia el segmento más numeroso, registrando 13.886 reacciones adversas.
Además, Pfizer reveló que el 2,9% de todos los casos, 1.223 en total, tuvieron un resultado fatal.
LEE MÁS:
Otros 11.361 casos se clasificaron con el resultado «no recuperado en el momento del informe», y 9.400 se clasificaron como «desconocido».
Además, si bien las reacciones adversas notificadas con mayor frecuencia fueron efectos secundarios como dolor de cabeza, náuseas y fatiga, el documento mostró la aparición de 1.927 informes de infección por COVID-19, una tasa del 4,5%.
Anafilaxia
En una tabla titulada Riesgo potencial importante, Pfizer señaló 1.833 «casos potencialmente relevantes» de anafilaxia, que, según dice, fueron «revisados individualmente y evaluados según la definición de la Brighton Collaboration (BC)».
Los niveles de BC se dividen en cinco rangos. El documento dice que el BC1 «indica un caso con el mayor nivel de certeza diagnóstica», mientras que «la certeza diagnóstica es la más baja» para el BC3.
El nivel 4 se considera un «evento notificado de anafilaxia con pruebas insuficientes para cumplir la definición de caso» y el nivel 5 se determinó que no era anafilaxia.
Los datos revelan que de los 1.833 casos, 601 fueron clasificados como BC1 o BC2.
En un desglose demográfico de los 1.002 casos que cumplían los criterios de BC1 a BC4, la mayoría de las anafilaxias se produjeron en Estados Unidos y el Reino Unido.
Desglosados por sexos, los datos mostraron una vez más que las mujeres se vieron afectadas de forma significativa, esta vez en una proporción de más de 8 a 1: 876 mujeres y 106 hombres formaban parte de la cohorte, con 20 casos que afectaban a personas de sexo «desconocido».
La edad media era de 42,5 años, y se registraron nueve muertes. En una nota a pie de página asociada a las estadísticas de muertes, Pfizer dijo: «Hubo 4 individuos en la evaluación de anafilaxia que murieron el mismo día en que fueron vacunados».
«Aunque estos pacientes experimentaron eventos adversos (9) que son síntomas potenciales de anafilaxia, todos tenían condiciones médicas subyacentes graves, y un individuo parecía tener también neumonía por COVID-19, que probablemente contribuyó a su muerte».
Enfermedades potenciadas por la vacuna
En una segunda tabla de Riesgo Potencial Importante, Pfizer discutió la Enfermedad Potencialmente Asociada a la Vacuna (VAED) y la Enfermedad Respiratoria Potencialmente Asociada a la Vacuna (VAERD), pero tenía pocos datos para informar, declarando: «No se han identificado informes de EAs post-autorizados como casos de VAED/VAERD, por lo tanto, no hay datos observados en este momento.»
No obstante, cuando Pfizer analizó sus datos en busca de casos «que indicaran una falta de efecto de la vacuna» o «potencialmente indicativos de COVID-19 grave o atípico», descubrió 138 casos.
71 casos fueron señalados como «médicamente significativos», con 8 marcados como «graves para la discapacidad».
Treinta y ocho se marcaron con resultado mortal.
Por género, el conjunto estaba compuesto por 73 mujeres, 57 hombres y 8 desconocidos.
Además de los 138 casos, se recuperaron 317 «eventos potencialmente relevantes». El más frecuente fue la «ineficacia de un fármaco», con un recuento de 135.
Abortos espontáneos
Los datos de Pfizer también encontraron 413 casos en una tercera tabla de Riesgo Potencial Importante relativa al «uso en el embarazo y la lactancia». De los casos, 84 fueron marcados como graves y 329 como no graves.
La mayoría, 205, se produjeron en Estados Unidos. Le siguieron 64 en el Reino Unido. De los 413 casos, 270 se referían a embarazos, con 4 casos en el bebé.
Entre los 270 embarazos, Pfizer admitió que 23 resultaron en «aborto espontáneo», con dos casos adicionales de «parto prematuro con muerte neonatal» y «aborto espontáneo con muerte intrauterina», y un caso más de «aborto espontáneo con muerte neonatal».
Además, Pfizer informó de 133 casos de reacciones adversas en bebés lactantes, que incluían 116 casos en los que el bebé estuvo expuesto a la vacuna a través de la leche materna, pero sin incurrir en una reacción adversa.







